Séminaire par Anne de Poulpiquet, Laboratoire de Bioénergétique et Ingénierie des Protéines, Aix-Marseille Université & CNRS
Dans le cadre de l’animation scientifique, Anne de Poulpiquet, chercheuse au Laboratoire de Bioénergétique et Ingénierie des Protéines, Aix-Marseille Université – CNRS, présentera une conférence intitulée “Microscopie de fluorescence in situ pour la caractérisation de la réactivité électro-enzymatique” le mardi 08 octobre à 11h en salle de séminaire.
Résumé de la présentation:
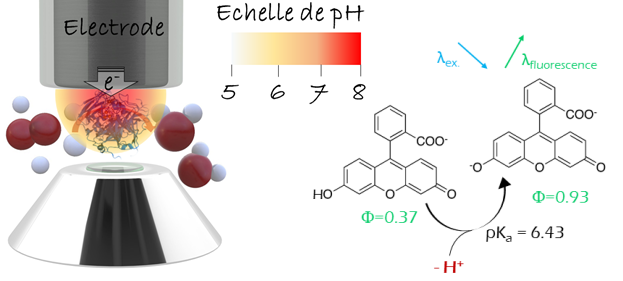
Les enzymes redox présentent des propriétés catalytiques remarquables (sélectivités exceptionnelles, constantes cinétiques élevées, faibles surtensions, etc.) qui sont particulièrement intéressantes pour les dispositifs bio-électrochimiques (biocapteurs, biopiles à combustible, bioréacteurs). Dans ces derniers, elles sont immobilisées à la surface d’une électrode pour permettre le transfert d’électrons. L’utilisation d’électrodes tridimensionnelles (3D) permet d’améliorer les performances des dispositifs (sensibilité, densités de courant). Cependant, la catalyse enzymatique est très sensible à l’environnement local (pH, température, force ionique, concentration de substrats, de produits ou d’inhibiteurs, etc.) dont la composition, dans le cas de réactions interfaciales, peut différer du volume de la solution. Ces disparités sont exacerbées lorsque les enzymes sont confinées dans les pores d’électrodes 3D, du fait de la complexité des transports de matière associé. Cependant, l’électrochimie ne fournit que des informations indirectes sur l’environnement de l’électrode, comme l’expansion et la composition de la couche de diffusion. Il y a donc un intérêt majeur à coupler les techniques électrochimiques à d’autres méthodes pour collecter simultanément des informations spatiales [1-4] et analyser les phénomènes associés à la réactivité électro-enzymatique. Je discuterai ici de la microscopie confocale de fluorescence, qui, couplée in situ et operando à l’électrochimie, fournit des informations précieuses sur la réactivité électro-catalytique des enzymes redox et les transports de matière associés [5, 6]. L’une des caractéristiques les plus intéressantes de la méthode est la possibilité d’enregistrer des séries d’images avec une très faible profondeur de champ à différentes coordonnées dans la direction axiale, et ainsi de reconstruire des profils de concentration 3D. L’enregistrement de la fluorescence dans le volume adjacent à l’électrode sous contrôle de potentiel permet ainsi de reconstruire la couche de diffusion [3-6]. Je montrerai que le couplage peut être mis en œuvre pour caractériser la catalyse électro-enzymatique au niveau de diverses électrodes planes ou structurées [5, 6]. Ainsi, la réduction enzymatique de O2 impliquant des transferts de protons a été mise en évidence grâce à l’évolution de la fluorescence de fluorophores fortement dépendants du pH. Les changements locaux de pH dans le plan de l’électrode ont été mesurés pendant la réduction de O2 catalysée par une enzyme immobilisée, la bilirubine oxydase. De plus, il a été possible de réaliser des images des gradients de protons générés pendant la réaction enzymatique à l’électrode, et de déterminer leur expansion dans diverses conditions expérimentales. Enfin, la méthode a permis l’imagerie directe de l’évolution des environnements confinés pendant la catalyse électro(enzymatique) dans des électrodes 3D poreuses telles que les électrodes à diffusion de gaz.
[1] L. Bouffier & T. Doneux, Curr. Opin. Electrochem. 6 (2017) 31-37.
[2] Zigah et al., ChemElectroChem. 6 (2019) 5524-5546.
[3] T. Doneux et al., Anal. Chem. 88 (2016) 6292-6300.
[4] A. de Poulpiquet et al., Chem. Sci., 9 (2018) 6622-6628.
[5] B. Tassy et al., Anal. Chem. 92 (2020) 7249–7256.
[6] H. M. Man et al.,Anal. Chem. 94 (2022) 15604−15612.


